死亡能改变儿童癌症研究现状吗?
文章来源:Nature自然科研 作者:施普林格•自然上海办公室翻译 责任编辑:admin & zhengty 时间:2018-10-08
表观遗传学的发现再次激发起了人们对困扰癌症生物学家许久的融合蛋白的兴趣。
1 尚未研究充分的“杀手”
2 期望越大,失望越大

Max Ritvo,摄于2014年
Ashley Woo
但这些阴性结果也并非毫无意义。许多成人癌症都包含多种突变,因此很难区分哪些是驱动肿瘤的突变,哪些是与肿瘤生长无关的无意义突变。同时,肿瘤也可能是多基因驱动的,这更是加大了治疗的难度。“简单的肿瘤基因组,例如尤文氏肉瘤基因组,可能靶点比较少,但正因为驱动因素少,这些肿瘤不容易对药物产生耐药性。”丹娜法伯研究所的儿童肿瘤学家Kimberly Stegmaier说,“这就是希望。”
3 简单粗暴的治疗手段
但希望并不等同于进展。自1993年以来,尤文氏肉瘤的治疗方法并无明显进展。目前的治疗包括几轮残酷的化疗、手术和放疗。
2007年,Max的化疗周期是3周,化疗后第一周一般会有呕吐和腹泻,有时还伴有肠道感染。化疗第二周采用的药物对血液系统影响较大,他常常因为重度贫血不得不住院。第三周是恢复期。随后又是一个新的周期。如此进行了四轮化疗后,他接受了手术治疗、放疗以及其它治疗。
Max用自己的幽默面对这一切治疗,除了一种药物——异环磷酰胺。异环磷酰胺让他出现幻觉,他无法用言语表达自己的想法,他只能不断重复两句话“我的头要炸了”以及“快给我蓝色药”。蓝色药是亚甲蓝,能够对抗异环磷酰胺的副作用。
化疗结束的时候,Max跟他妈妈发誓再也不要使用这种药物了。
尽管治疗过程非常痛苦,Max的病情得到了缓解。他基本恢复了正常的青少年生活,在接下来的几年里,他恋爱然后失恋,沉迷网络又摆脱网瘾,最终他选择在诗歌和哲学中寻找生活的真谛。
但他曾经罹患癌症的经历还是对他产生了影响。在耶鲁大学的第一年,他陷入极度的担忧,担心异环磷酰胺会影响他的记忆力。这种担忧让他开始写诗,他后来回忆起来说,之所以选择写作是为了保留那些可能会失去的记忆。
在大学的最后一年,他的情绪终于稳定下来了。他和别人一道创办了喜剧团,写诗也不再仅仅为了保留记忆。他想忘记过去的肿瘤经历,但事与愿违。2012年,他的肿瘤复发了。他妈妈搬到了耶鲁附近的一家酒店里,接送Max往返于医院和学校,以便他能按时毕业。
大约就在那个时候,针对致癌相关融合蛋白的研究再次兴起。在Max求学耶鲁期间,斯坦福大学的生物化学家Cigall Kadoch及其同事正在研究一组能够共同修饰染色质的蛋白质。染色质里除了DNA,还有多种蛋白质,这些蛋白的功能是包装和组织细胞内的遗传物质。染色质可以“打开”,允许内部基因表达,也可以紧密缠绕,避免基因表达。
2013年,Kadoch的团队报道了一种名为SS18的蛋白质,他们认为这种蛋白参与了染色质聚合和解聚。一旦SS18与SSX蛋白融合形成嵌合体取代了正常的SS18蛋白,就会对染色质的正常聚合和解聚造成破坏。Kadoch的研究小组发现这会增加致癌基因表达,从而导致了儿童滑膜肉瘤的发生。
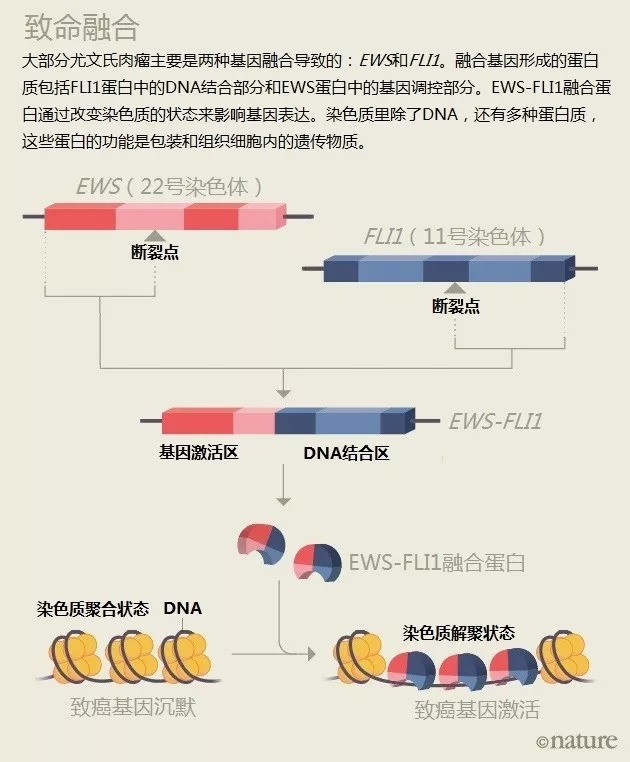
除了Kadoch的研究,还有越来越多的证据表明融合蛋白和表观遗传学有关。研究白血病和尤文氏肉瘤的研究人员也发现了类似的联系(见“致命融合”)。
Kadoch现在在丹娜法伯有自己的实验室,常常有别的研究融合蛋白的科研工作者向她取经,想要进一步了解她所使用的生物化学方法。她是发现致癌相关融合蛋白和染色质之间关系的第一人。“许多融合蛋白能够与染色质修饰复合物相互作用,导致发生不应有的基因表达。”丹娜法伯研究所的儿童肿瘤学家Scott Armstrong说,他一直致力于探索表观遗传学在儿童白血病的作用。
目前有部分针对表观遗传蛋白的药物已经在开发中了。例如BRD4蛋白抑制剂或可用于治疗一些融合蛋白驱动癌症,包括横纹肌肉瘤和部分白血病。类似的方法可能也适用于EWS-FLI1蛋白,EWS-FLI1与表观遗传调控蛋白LSD1存在相互作用。Lessnick是德克萨斯Salarius Pharmaceuticals公司的代理首席医疗官,该公司正在开发一种LSD1抑制剂,并计划在尤文氏肉瘤患者中进行试验。
4 绝望的日子
Max和Ariella对这些研究项目十分熟悉。Ariella在纽约市主持 Alan B. Slifka 基金会的工作,该基金会是由Ariella已故丈夫创立的慈善组织,专注于支持犹太人群。 Max生病之后,Ariella扩大了基金会的资助范围,将肉瘤研究也作为支持项目。
Max和 Ariella也和其他有尤文氏肉瘤儿童的家庭建立了联系网。Ariella与那些同样渴望得到有效治疗的儿童父母交换了治疗相关的意见、传言和科学进展;Max也和一些和他患有一样疾病的小伙伴成为了好朋友。
从某种意义上说,Max肿瘤复发的时间非常巧:他已经22岁了,他现在可以参加那些只对成人开放的临床试验了。Ariella对这一点很感激,但她也看到了其中的不公平。 “有些孩子没有时间等到18岁。”她说, “他们会死。”
2012年,Max开始了新的化疗周期:总共12轮。他的医生再次推荐异环磷酰胺,但Max拒绝了。在接下来的4年里,他尝试了各种各样的试验性疗法。
他的母亲向美国食品和药物管理局(FDA)申请特别许可,尝试一种尚未在儿童中试验过的免疫治疗药物。人们担心这种药物可能不适用于突变基因较少的肿瘤,例如尤文氏肉瘤,因为大家认为突变基因产生的蛋白质能够刺激免疫反应产生。Max使用这种药物后,癌症的扩散似乎加速了。
2015年,Ariella和Max将他的肿瘤细胞送到一家公司,该公司用这些细胞在小鼠体内“种植”了肿瘤,随后将这些肿瘤小鼠作为Max的替身,尝试了多种药物。能成功使小鼠身上肿瘤缩小的药物很可能对Max也有效。
Max是一个素食主义者,他觉得这种方法既吸引人又令人不安:带着他身体一部分的小鼠正在死去,但只有这样才能为他带来生的希望。当一种实验性药物在其中一只小鼠身上显示出效果的时候,Ariella就急忙去向FDA申请特批在Max身上使用。但这种药物并没有带来特别明显的疗效。
Max在尝试各种实验性治疗期间,取得了硕士学位,结了婚,开始准备他的第一本诗集。随着健康状况的恶化,Max的体重不断下降。2016年7月,这位身高1.8米的诗人体重已经不足51公斤了。
5 “迟到”的希望
当Max还是一个孩子的时候,他每周一都会和妈妈一起在床上看动画片。 这对他来说是一个神圣的仪式,他甚至给他家的狗取名为Monday(“周一”)。
2016年8月中旬,轮到Ariella照料病床上的Max。她和Max的妻子Victoria一直密切注意Max,定期将他俯卧的躯干抬起来拍打背部,希望帮助清理他的肺部。Max的呼吸极为粗重,Ariella会因此做噩梦。她还担心尽管Max已经昏迷,但他仍会因为大量胸腔积液而产生类似溺水的感觉。
8月23日,Max粗重的呼吸停止了,当时Ariella正握着他的手。Ariella对Max的遗体进行了细致的清理,然后坐下来等待太平间工人把他带走。
Max去世两个星期后,美国癌症登月计划(US Cancer Moonshot)的顾问就建议针对融合蛋白进行研究。这项雄心勃勃的计划旨在加速癌症研究的步伐。儿童肿瘤学家希望这不仅仅是为某一特定领域的研究提供机会,更希望儿童癌症作为一个整体能受到更多关注。
“我们希望关注那些亟待解决的需求。”田纳西州圣犹达儿童研究医院院长James Downing说,他参与整理了“登月计划”建议。
整个提案在去年9月初步成形,推荐了一套系统研究癌症相关嵌合蛋白的体系。这个提案借鉴了Kadoch及其同事用于揭示表观遗传学与滑膜肉瘤之间联系的生化方法,但是需要更理想的细胞培养方法和动物模型,这是该研究领域的主要瓶颈。
Lessnick每月都会与其他研究尤文氏肉瘤的研究人员召开电话会议。 “我们可以自由分享数据,而不必担心竞争。”他说, “我们人这么少,但需要做的工作还有那么多。”
即使经过25年的挫折,他仍然保持乐观,他希望“登月计划”带来的关注和资金可以吸引来自其他领域(如表观遗传学)的研究人员,从而带来全新的视角。 “以前我们没有这么好的渠道建立不同领域之间的联系。”他说。
在Max生命的最后几年,Ariella将自家的基金会专注于后期研究:即将可以实现临床转化的研究,任何可以及时拯救她儿子生命的研究。现在,她打算重新调整其基金的关注重点,未来基金会将资助更多基础研究,因为这是该领域最需要的。她说:“现在我最不缺的就是时间了。”
________________________________________
版权声明:
本文由施普林格•自然上海办公室负责翻译。中文内容仅供参考,一切内容以英文原版为准。欢迎转发至朋友圈,如需转载,请邮件Chinapress@nature.com。未经授权的翻译是侵权行为,版权方将保留追究法律责任的权利。
© 2018 Springer Nature Limited. All Rights Reserved
相关文章
志愿者名单
软组织肉瘤百科编译志愿者清单
上海儿童医学中心肿瘤外科顾松医生等你来提问!
上海儿童医学中心肿瘤外科顾松医生等你来提问!
儿童实体肿瘤的确诊和治疗
中国抗癌协会小儿肿瘤专业青年委员会副主任委员黎阳介绍儿童实体瘤的治疗
孩子手术后排便问题如何解决?
邀请到首都医科大学附属北京儿童医院肿瘤外科的秦红主任,问答专题为“儿童实体肿瘤外科规范化综合诊疗”。
横纹肌肉瘤
儿童横纹肌肉瘤是肌肉组织中恶性(癌症)细胞形成的疾病。








